In diesem Artikel geht es um die Vermittlung eines praktischen Leitfadens zur Titration. Dieser gibt Einblicke in die Grundlagen, Methoden und Anwendungsbereiche der Titration.
Praktischer Leitfaden über die Titration

Kennen Sie den Unterschied zwischen automatisierter und manueller Titration und die Vorteile beider Methoden? Benötigen Sie Hilfe, welche Methode für Ihre spezielle Anwendung geeignet ist oder suchen Sie Tipps zur Verbesserung der Genauigkeit? Die Titrationsfibel verknüpft Applikationsinformationen mit den praktischen Laborerfahrungen unserer Titrationsexperten. Dieses Handbuch für die Titration setzt chemische Kenntnisse voraus, so z.B. das Lesen von Reaktionsgleichungen, die Kenntnis von wichtigen Fachbegriffen, Grundkenntnisse für das Arbeiten im chemischen Labor, wie auch den Umgang mit Geräten wie Waagen, Büretten, Pipetten, Elektroden und den Sicherheitsbestimmungen im Labor.
Die Titration ist eine der ältesten Methoden zur Gehaltsbestimmung in der Chemie und findet breite Anwendung in der chemischen Analytik. Zum einen ist eine Titration sehr einfach und schnell durchzuführen, zum anderen liefert die Titration bereits nach wenigen Minuten - bei optimalen Bedingungen - ein sehr genaues Messergebnis. Eine relative Standardabweichung von unter einem Prozent ist normal. Nicht ohne Grund verlangen zahlreiche Normen die Titration als Methode.
Diese Erklärung der Titration baut auf den allgemeinen Grundlagen der Titration auf und wendet sich an den Anwender der potentiometrischen Titration. Deshalb wird auf die Grundlagen der Potentiometrie mit der Nernstschen Gleichung eingegangen.
Titrationsreaktionen
Die Definition der Titration gilt im Kern unverändert: Wir brauchen eine stöchiometrische Reaktion, ein genau dosierbares, stabiles Reagenz und eine Detektion des Reaktionsendes oder eine Kurve, aus der der Ablauf der Reaktion ersichtlich ist.
- Die der Titration zugrundeliegende chemische Reaktion muss schnell, quantitativ und eindeutig in der Weise ablaufen, wie die Reaktionsgleichung angibt.
- Es muss möglich sein, eine Reagenslösung definierter Konzentration herzustellen oder die Konzentration der Lösung auf geeignetem Wege exakt zu bestimmen.
- Der Endpunkt der Titration muss deutlich zu erkennen sein. Er soll mit dem Äquivalenzpunkt, an dem gerade die der Stoffmenge gesuchten Stoffes äquivalente Reagensmenge zugefügt wurde, zusammen-fallen oder zumindest ihm sehr nahekommen.
Eine einfache und sehr zuverlässige Methode ist die Säure-Base-Titration, die schon sehr lange zur Bestimmung der Konzentration wässriger Lösungen angewendet wird. Bei der Säure-Base-Titration oder Neutralisationstitration werden Säuren mit einer Base (oder umgekehrt) titriert. Die Detektion des Äquivalenzpunktes kann durch Farbindikatoren oder Potentiometrisch mit einer Glaselektrode erfolgen. Die Reaktion ist bei allen Säure-Base-Titrationen gleich, aus einem Proton und einem Hydroxidion entsteht Wasser. Säure-Base-Titrationen sind hauptsächlich in der Anwendung: für die Überwachung von Umweltprozessen, wie die Analyse der Wasser- und Bodenqualität, aber auch bei der Herstellung von Lebens- und Arzneimitteln.
Manuelle und automatische Titration im Vergleich
Auch wenn heute noch manuelle Titrationen durchgeführt werden, sprechen die vielen Vorteile für den Einsatz eines automatischen Titrators.

Abb. 1: Titrations-Fibel S. 46 Beispiel für einen automatischen Titrator: TitroLine TL 7800-M1.
In Abb. 2 werden die beiden Anwendungsformen verglichen. Die manuelle Titration ist oftmals schneller. Die Dauer der Titration setzt sich aus der Reaktionsdauer und der Dauer der Einstellung des Sensorpotentials zusammen.

Abb. 2: Titrations-Fibel S. 47 Tabellarische Aufstellung der Vor- und Nachteile
Bei der manuellen Titration entfällt der Sensor und damit auch dessen Einfluss auf die Gesamt-Titrationsdauer. Bei langsamen Reaktionen kann eine zu schnelle manuelle Titration zu Über- oder Unterbefunden führen. So sind z.B. einige Redoxreaktionen so langsam, dass sie bei höheren Temperaturen verlaufen oder Katalysatoren zugesetzt werden müssen. Hier besteht die Gefahr, dass die Titration bei der manuellen Bestimmung zu schnell ist und die chemische Umsetzung nicht folgen kann.
Die automatische potentiometrische Titration arbeitet driftkontrolliert, d.h. mittels Sensors kann der Fortschritt der Reaktion überwacht werden. Bei der manuellen Titration mit Indikatoren wird so lange titriert, bis die Farbe umschlägt. Bei der Gehaltsberechnung wird also genau ein Punkt der gesamten Titration zur Auswertung herangezogen.
Es gibt somit keine Möglichkeit, Informationen zu erhalten über:
- Reaktionsverlauf
- Signal-Rausch-Verhältnis
- Verhalten direkt vor und nach dem Endpunkt
- Merkmale für eine Unsicherheitsbetrachtung
- Gibt es mehrere „Endpunkte“?
Bei der potentiometrischen Titration liegt die gesamte Titrationskurve vor und damit auch Bewertungskriterien zu den obigen Punkten. Zudem werden für eine Äquivalenzpunktberechnung mehrere Messpunkte im Bereich des Äquivalenzpunktes herangezogen.
Bei der Endpunkt-Titration wird ebenfalls auf einen Punkt titriert. Die direkte potentiometrische Umsetzung einer manuellen Titration ist also eine Endpunkttitration auf den Punkt, bei dem der Indikator seine Farbe ändert. Im Gegensatz zur manuellen Titration steht auch hier zur Bewertung eine komplette Titrationskurve zur Verfügung.
In Abb. 3 ist der Äquivalenzpunkt der Titration bei pH 7,42. Der Farbumschlag beginnt bei pH 6,80, eine Endpunkt-Titration würde man bei pH 7,00 beenden. Da die Titrationskurve jedoch sehr steil ist, sind Unterschiede im Verbrauch, welcher ja die Messeinheit der Titration ist, sehr gering. Bei flachen Titrationskurven können im Gegensatz dazu erhebliche Unterschiede auftreten. Die drei unterschiedlichen Detektionen (optisch- manuell, EP-Titration und EQ- Titration) müssen daher als (etwas) unterschiedliche Methoden aufgefasst werden.
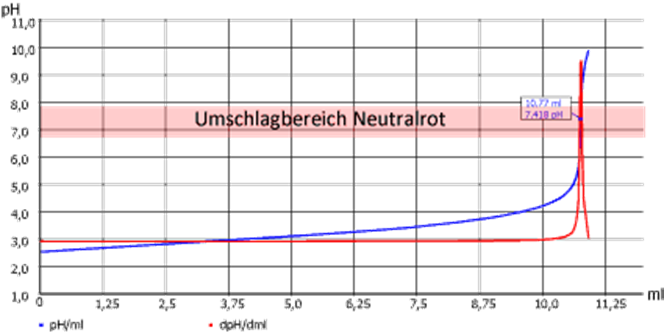
Abb. 3: Titrations-Fibel S. 49 Beispiel einer Titrationskurve
Inhalt der Titrationsfibel (ein Auszug der 192 Seiten kompakten Titrationswissens)
1. Allgemeine Grundlagen der Titration
- Titrationsreaktionen (z.B. Säure-Base-Titration, Fällungstitration, Komplexometrische Titration, Redoxtitration, Ladungstitration, chemisch/visuell, Potentiometrisch, Biamperometrisch, Photometrisch, Konduktometrisch, Thermometrisch)
- Titrationsarten (Direkte Titration, Rücktitration, Indirekte Titration, Substitutionstitration, Phasentransfertitration)
- Überblick über verwendete Methoden
2. Volumenmessgeräte, manuelle und automatische Titration
- Volumenmessgeräte im Labor
- Überprüfung des richtigen Volumens
- Vergleich manuelle und automatische Titration
3. Probenhandhabung
4. Sensoren und Reagenzien
5. Titrationsparameter und Berechnungen
- Einstellverhalten der Elektrode und Geschwindigkeit
- Definition des Titrationsendes
- Auswertung der Titration
6. Anwendungen
- Säure-Base-Titrationen
- Argentometrische Titrationen
- Potentiometrische Redoxtitrationen
- … und einige mehr
7. Photometrische Titrationen
9. Verifizierung der Titration
Weitere Infos finden Sie in dem Titrationskatalog

Finden Sie hier alle Komponenten für eine manuelle oder automatisierte Titration mit unserer hochpräzisen Software Titri Soft 3.5 für Ihren Einsatz im Labor. Erfahren Sie mehr zu allen Produkten im Laborumfeld: coulometrische und volumetrische Titratoren, Büretten, Probenwechsler, die passende Software und die entsprechenden Titrations-Elektroden und sämtliches Zubehör rund um die Titration.
Mehr erfahren
Erweitern Sie Ihr Titrationswissen mit der Titrationsfibel
 Dies ist ein Auszug aus der Titrationsfibel. Auf 192 Seiten bietet sie eine kompakte Einführung in die Theorie und Praxis der Titration. Bei Interesse können Sie die Fibel gerne als PDF herunterladen oder als Broschüre anfordern. Und in unserer Datenbank finden Sie zahlreiche Applikationen für Ihre Titration zum Download. Ein konkretes Anwendungsbeispiel der Bestimmung von Säure in Basen wird in dem Artikel "Wie bekomme ich korrekte und reproduzierbare Ergebnisse in der Titration?" beschrieben. Weitere Fragen unserer Kunden beantwortet unser Titrationsexperte im Blogartikel FAQ zur Titration.
Dies ist ein Auszug aus der Titrationsfibel. Auf 192 Seiten bietet sie eine kompakte Einführung in die Theorie und Praxis der Titration. Bei Interesse können Sie die Fibel gerne als PDF herunterladen oder als Broschüre anfordern. Und in unserer Datenbank finden Sie zahlreiche Applikationen für Ihre Titration zum Download. Ein konkretes Anwendungsbeispiel der Bestimmung von Säure in Basen wird in dem Artikel "Wie bekomme ich korrekte und reproduzierbare Ergebnisse in der Titration?" beschrieben. Weitere Fragen unserer Kunden beantwortet unser Titrationsexperte im Blogartikel FAQ zur Titration.
Weitere Fragen werden im Blogartikel FAQ Titration von unserem Experten beantwortet. Hilfreiche Tipps für Ihren Anwendungsbereich, können Sie in unseren anderen Blogartikeln nachlesen:
Blog Welche pH-Elektrode brauche ich für meine Säure-Base Titrationsanwendung?
Blog: Welche Elektroden können noch für die Titration genutzt werden?
Blog: Wie bekomme ich korrekte und reproduzierbare Ergebnisse in der Titration?
Blog: Fragen und Antworten unseres Experten für Ihre Titration