04.07.2024
| Dr. Klaus Reithmayer
Hier erfahren Sie von unserem Experten wie Sie den wichtigen Messparameter "Gelöster Sauerstoff" am besten Messen.
 Gelöster Sauerstoff ist ein reaktionsfreudiges Gas, das macht man sich bei der Messung zu Nutze. Bis zu Beginn der 60er Jahre des 20. Jahrhunderts gab es keine einfache Lösung zur Bestimmung des gelösten Sauerstoffs, es wurde in der Regel ein Titrationsverfahren herangezogen, die sogenannte Winkler-Titration, die von Lajos Winkler 1888 publiziert wurde. Dabei wurde mittels eines Titrationsverfahrens über Iodometrie der gelöste Sauerstoff bestimmt. Es handelt sich um einen mehrstufigen Prozess, der mit einigem Aufwand und entsprechenden Unsicherheiten nur unter Laborbedingungen durchzuführen ist.
Gelöster Sauerstoff ist ein reaktionsfreudiges Gas, das macht man sich bei der Messung zu Nutze. Bis zu Beginn der 60er Jahre des 20. Jahrhunderts gab es keine einfache Lösung zur Bestimmung des gelösten Sauerstoffs, es wurde in der Regel ein Titrationsverfahren herangezogen, die sogenannte Winkler-Titration, die von Lajos Winkler 1888 publiziert wurde. Dabei wurde mittels eines Titrationsverfahrens über Iodometrie der gelöste Sauerstoff bestimmt. Es handelt sich um einen mehrstufigen Prozess, der mit einigem Aufwand und entsprechenden Unsicherheiten nur unter Laborbedingungen durchzuführen ist.
Die Familie der elektrochemischen Sensoren
1962 publizierte Leland Clark (1918 – 2005) die nach ihm benannte Clark-Elektrode, die die Urmutter der elektrochemischen Sauerstoffsensoren darstellt. Dabei handelt es sich um eine durch eine gaspermeable (Teflon®)-Membran vom zu untersuchenden Medium abgetrennte elektrolytgefüllte elektrochemische Zelle mit einem Elektrodensystem, in der der gelöste Sauerstoff auf der Oberfläche einer spannungsführenden Elektrode reduziert wird. Der dabei fließende Strom ist ein direktes Maß für den verbrauchten Sauerstoff und kann daher zu dessen Messung herangezogen werden.
Bei dieser Art der Zelle wird vom Messgerät zwischen den Elektroden eine definierte Spannung angelegt, bei der dieser Vorgang optimal läuft. Nach diesem Prinzip arbeiteten und arbeiten Sensoren der Marke WTW®, zum Beispiel die in der Abwasseranalytik eingesetzten Sensoren der TriOxmatic®-Familie. Der Name TriOxmatic® leitet sich dabei von einer dritten Elektrode ab, die die Qualität des eingesetzten Elektrolyten überwacht und ein Signal zu dessen Austausch gibt. Ein weiterer Typ von Gelöst-Sauerstoffsensoren wurde bei WTW® entwickelt und findet auch heute noch weite Verbreitung gerade im Feld, aber auch in Laboranwendungen: Die Familie der galvanischen Sauerstoffsensoren vom Typ CellOx®.
Die schematische Zeichnung zeigt den Aufbau:
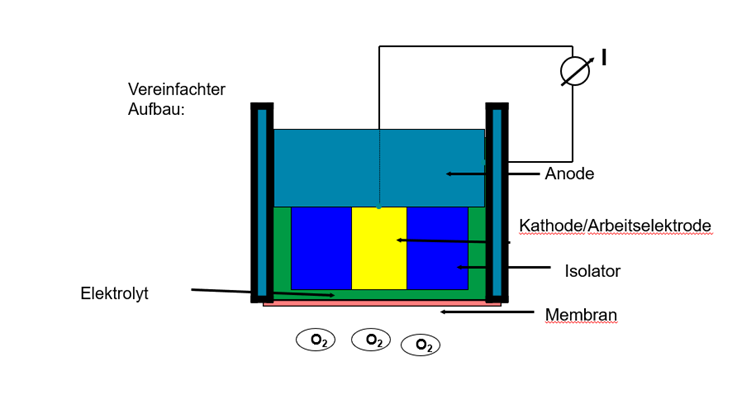 Abb. 1: Schematischer Aufbau eines galvanischen (polarographischen) Sauerstoffsensors
Abb. 1: Schematischer Aufbau eines galvanischen (polarographischen) Sauerstoffsensors
Im Gegensatz zu polarographischen Sauerstoffsensoren besitzen diese Sensoren eine Art innere Batteriezelle, die von selbst die benötigte Spannung erzeugt: Die Kathode besteht aus Gold, die Anode aus Blei.
Dabei läuft in Anwesenheit von Sauerstoff folgende Redox-Gleichung ab:
2 Pb → 2 Pb2+ + 4e- Oxidation
4e- + O2 + 2 H2O → 4OH- Reduktion
2 Pb + O2 + 2 H2O → 2 Pb(OH) 2 Gesamtreaktion
Damit wird ersichtlich, dass diese Sensoren Wartung benötigen, denn der Niederschlag aus Bleihydroxid muss von Zeit zu Zeit entfernt werden. Der Vorteil liegt jedoch auf der Hand, diese Sensoren müssen nicht wie polarograhische Sensoren entweder permanent oder aber zumindest eine gewisse Zeitspanne mit dem Messgerät verbunden sein, um ihre volle Funktionsfähigkeit zu erlangen, sondern sind praktisch auch im abgesteckten Zustand betriebsbereit und funktionieren sofort nach dem Anstecken bzw. Einschalten. Die Funktionsweise elektrochemischer Sauerstoff-Sensoren ist auch in der DIN EN ISO 5814 beschrieben.
Besonderheiten der elektrochemischen Sauerstoffsensoren
Elektrochemische Sauerstoffsensoren verbrauchen, wie man an der obigen Gleichung sieht, Sauerstoff. Dieser Sauerstoff muss zugeführt werden. Im Labor ist es erforderlich zu rühren, bei Gewässern wie Flüssen, Bächen oder Seen genügt im Allgemeinen die natürliche Anströmung. Ist das nicht gewährleistet verbraucht der Sensor mehr Sauerstoff als ihm zugeführt wird und es kommt zu Minderbefunden.
Die Messung mit Optoden
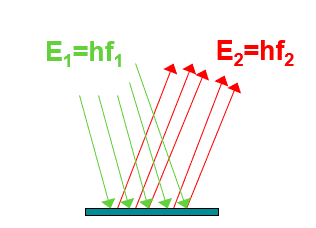
Abb. 3: Fluoreszenz: Licht mit einer höheren Energie führt zur Anregung des Farbstoffs und Abstrahlung von Licht mit einer niedrigeren Energie
In den 90er Jahren des 20. Jahrhunderts begann die Entwicklung optischer Sauerstoffsensoren, sogenannter Optoden, zunächst im medizinischen Bereich zur Messung der Respirometrie. Anfang der 2000er Jahre erreichte diese Art der Messung auch den Umweltmarkt.
Das Prinzip dieser Messung basiert auf dem sogenannten Quenchen, beschrieben durch die Stern-Volmer Gleichung.
Es gibt Farbstoffe, die bei Bestrahlung mit kurzwelligem Licht in einen angeregten Zustand übergehen und ihrerseits Licht emittieren, dieses Verhalten nennt sich Fluoreszenz. Das emittierte Licht ist deutliche langwelliger und damit niederenergetischer als das eingestrahlte Licht.
Diese Fluoreszenz eines geeigneten Farbstoffs wird in Abhängigkeit von der Konzentration eines sogenannten Quenchers (in unserem Fall der Luftsauerstoff) vermindert bzw. gelöscht.
Dabei ist F0 die Fluoreszenzintensität des fluoreszierenden Farbstoffs bei Abwesenheit des Quenchers, F die aktuelle Intensität in Anwesenheit des Quenchers, K die Stern-Volmer Konstante und [C] die Konzentration des Quenchers.
Phasenverschiebung zwischen anregendem und abgestrahltem Licht
Neben der Intensitätsverringerung kommt es zu einem deutlich stabileren Verhalten: Mit steigender Konzentration des Quenchers verschiebt sich der Phasenwinkel zwischen eingestrahltem und fluoresziertem Licht:
Maximale Intensität bei Abwesenheit von Sauerstoff
Intensitätserniedrigung und Phasenverschiebung bei erhöhter Sauerstoffkonzentration Auch diese Methode ist mittlerweile ein internationaler Standard und in der DIN ISO 17289-12 2014 beschrieben. Bei Xylem arbeiten sowohl der für den Abwasserprozess konstruierte FDO® 700 IQ als auch der für Labor- und Feldanwendungen konzipierte FDO® 925 nach diesem Prinzip.
Da optische Sauerstoffsensoren keinen Sauerstoff verbrauchen, ist Rühren prinzipiell nicht erforderlich, aber es unterstützt den Austausch des in der in der Deckschicht gelösten Sauerstoffs, die den Farbstoff vor Beschädigung schützt.
Hier finden Sie weitere Blogartikel zum Gelösten Sauerstoff:
Blog: Kalibrierung eines Sauerstoffsensors
Blog: Sensoren für die Gelöst-Sauerstoffmessung
Blog: Gelöster Sauerstoff – Eine Einführung